Stenturile coronariene
Autor: Oltean Alina
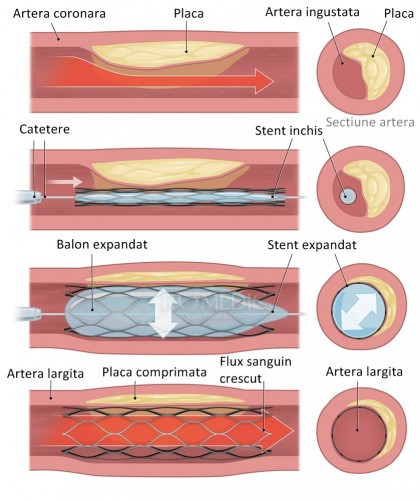
Stentul coronarian este plasat la nivelul arterelor coronare stenozate, cu scopul de a le menţine deschise şi a asigura astfel un flux circulator adecvat necesităţilor cordului.
Stentul reprezintă una dintre cele mai importante achiziţii ale terapiei intervenţionale, fiind un tub format dintr-o reţea metalică expandabilă, aplicat endarterial în scop terapeutic pentru tratamentul stenozelor arteriale. Construcția stenturilor sub formă de plasă sau spiră este pentru a minimaliza suprafața de expunere a metalului la fluxul sangvin, scăzând potențialul trombogenic al acestora.
Stenturile coronariene au fost introduse în anii ’80 pentru tratarea stenozelor coronariene şi scăderea ratei restenozelor, frecvent întâlnite post-angioplastie simplă cu balon (peste 30% dintre pacienţii supuşi angioplastiei cu balon necesitau proceduri intervenţionale repetate în acest sens). În prezent angioplastia coronariană cu stent este principala şi cea mai importantă metodă de tratament a bolii coronariene şi a complicaţiilor ei, fiind foarte frecvent practicată ca şi alternativă superioară trombolizei şi mai puţin riscantă decât bypass-ul aorto-coronarian. [6]
Principalul avantaj al utilizării stentului coronarian este scăderea ratei de restenoză. Aceasta este prevenită în mare parte prin împiedicarea colabării tardive şi mai ales prin împiedicarea proliferării celulare (în cazul stenturilor farmacologic active).
Stenturile coronariene sunt impărțite în două categorii majore: stenturile metalice şi stenturile active farmacologic. Pe lângă acestea au mai apărut noi tipuri de stenturi precum stent-grafturile în care scheletul metalic este dublat de un înveliş sintetic (polietilenă) sau natural (arteră sau venă umană) sau stenturile bioresorbabile. Graft-stenturile prezintă utilitate clinică în cazul perforaţiilor ameninţătoare de viaţă sau pentru excluderea anevrismelor, pseudoanevrismelor, fistulelor şi disecţiilor importante.
Caracteristicile şi proprietăţile stenturilor coronariene
În practica actuală se utilizează diferite tipuri de stenturi în funcţie de necesităţi, clasificarea lor realizându-se în funcţie de mai multe criterii:
(1) mecanism de fixare – în funcţie de acest criteriu stenturile pot fi auto-expandabile (eliberarea din dispozitivul de protecţie determină expansiunea stentului la dimensiunea vasului) sau balon-expandabile (fixate prin umflarea balonului).
(2) material - în funcţie de substratul materialului din care sunt confecţionate există: stenturi din oţel inoxidabil (cea mai mare parte), stenturi din nitinol (cele auto-expandabile) şi stenturi din aliaj de cobalt şi miez de platină sau cobalt şi crom sau platină şi crom.
(3) configuraţie – în ceea ce priveşte construcţia sau modelul, stenturile pot fi: inelare, tubulare, multidesign, plasă, etc. [7]
(4) înveliş – există stenturi fără înveliş, cu înveliş pasiv (cu eliberare de heparină sau politetrafluoretilenă) sau cu înveliş bioactiv (eliberare de sirolimus sau paclitaxel, cu acţiune citostatică).
(5) bioabsorbţia – determină clasificarea stenturilor în inerte (biostabile) şi biodegradabile (bioresorbabile). [1]
Toate aceste caracteristici conferă stenturilor proprietăţi importante precum:
(1) forţa radială, care reprezintă capacitatea de a susţine structura vasculară și de a se opune reculului plăcii ateromatoase;
(2) flexibilitatea, se referă la expansiunea uniformă a stentului în vasele cudate, fără apariţia cudurii intrastent;
(3) radioopacitatea, se referă la vizibilitatea stentului sub control fluoroscopic, facilitând astfel plasarea acestuia la un nivel dorit;
(4) posibilitatea de deschidere laterală în abordarea bifurcaţiilor vasculare;
(5) densitatea dată de elementele constitutive, care împiedică colabarea materialului endovascular; [2, 7]
Aceste proprietăţi nu se reunesc toate într-un stent, însă cunoaşterea lor permite alegerea tipului de stent optim pentru o anumită leziune.
Tipuri de stenturi
Stenturile metalice („Bare Metal Stents”)
Stenturile metalice (BMS) sunt primele endoproteze dezvoltate ca răspuns la angioplastia cu balon a cărei rata de restenoză s-a dovedit a fi crescută (aproximativ 30% la 3-6 luni), fiind introduse pentru prima dată în anul 1986. Deşi BMS au scăzut rata de restenozare comparativ cu angioplastia simplă (cu păstrarea însă a unui procent mare de restenoză de 20-40%), sunt asociate cu altă complicaţie importantă, şi anume, tromboza de stent, care apare cu precădere perioperator şi în perioada imediat dupa implantare. [1]
Studiul Benestent a comparat eficacitatea stenturilor metalice balon-expandabile cu angioplastia cu balon la pacienţii cu boală coronariană. Conform rezultatelor, utilizarea stenturilor a fost asociată cu o scădere a ratei restenozei clinice şi angiografice cu 10-15% comparativ cu terapia prin dilatare cu balon. De asemenea, angioplastia cu stent a fost asociată cu rezultate angiografice iniţiale semnificativ mai bune, cu un diametru minimal al lumenului post-procedural mai mare şi cu scăderea incidenţei disecţiilor reziduale. Totuşi, beneficiul clinic şi angiografic obţinut prin utilizarea angioplastiei cu stent este contrabalansat de asocierea cu o incidenţă crescută a complicaţiilor vasculare periferice la locul de acces (necesitând uneori intervenţii chirurgicale sau transfuzii sangvine) şi de o perioadă mai lungă de spitalizare comparativ cu angioplastia cu balon. [1, 8]
BMS sunt asociate cu restenoză tardivă prin îngustarea progresivă a lumenului arterial, fiind pusă pe seama reendotelizării scheletului metalic şi apariţiei în timp a aterosclerozei.
În prezent se utilizează, din ce în ce mai frecvent, stenturile confecţionate dintr-un aliaj de crom-cobalt sau crom-platină al căror schelet metalic este mai subţire, păstrând aceeaşi forţă şi vizibilitate ca şi consacratele stenturi din oţel inoxidabil şi care, conform studiilor clinice sunt asociate cu proliferare neointimală redusă şi atenuarea ratei de restenoză. [1] Referitor la stenturile auto-expandabile, cel mai utilizat material este nitinolul, un aliaj nichel-titan, care păstrează memoria formei cu dimensiune şi configuraţie prestabilite. Nu s-a pus în evidenţă o legătură între un anumit material din care este realizat stentul şi rata de tromboză sau de restenoză (cu excepţia aurului asociat cu risc crescut de restenoză). [1]
Stenturile utilizate în patologia coronariană sunt în cea mai mare parte stenturi balon-expandabile, introduse intravascular în stare colabată plasate pe un balon (la fel, colabat, în momentul introducerii), care este umflat la locul de stenoză, determinând expansiunea stentului şi fixarea acestuia endarterial; balonul este ulterior îndepărtat.
În ceea ce preveşte limitele implantării stenturilor coronariene metalice, cea mai redutabilă rămâne restenoza, aceasta fiind considerată „călcâiul lui Ahile” al angioplastiei cu stent metalic. [1]
Stenturile active farmacologic („Drug Eluting Stents”)
Stenturile active farmacologic (DES) reprezintă o categorie mai nouă, superioară BMS, de stenturi coronariene. Acestea păstrează avantajul mecanic al stenturilor metalice BMS, având şi proprietăţi antirestenotice prin eliberarea de substanţe antiproliferative în lumenul arterial cu scăderea semnificativă a proliferării intrastent, favorizând reducerea ratei de restenoză clinică şi angiografică. Stenturile DES au fost create tocmai în acest scop, ca răspuns la stenturile metalice asociate cu o rată mare a restenozei prin hiperplazie neointimală. [1]
Stenturile active prezintă trei componente necesare funcţionalităţii acestora:
(1) stentul propriu-zis (incluzând sistemul de implantare)
(2) substanţa activă eliberată
(3) transportorul substanţei active sau „carrier” (controlează dozajul şi rata de eliberare a acesteia) [3]
Transportorul este necesar pentru eliberarea unei doze adecvate de substanţă activă. La prima generaţie de DES, acesta consta dintr-un polimer durabil, care se consideră a determina un răspuns inflamator vascular. Există stenturi active, de generaţii mai noi, la care optimizarea distribuirii locale a agentului farmacologic activ permite reducerea dozei de medicament; de asemenea, modificarea suprafeţei stentului poate permite eliberarea directă a substanţei active, fără a mai fi necesar un transportor.
Cele mai eficace substanţe citostatice utilizate în vederea inhibării neoproliferării s-au dovedit a fi rapamicina (sirolimus) şi analogii săi, şi paclitaxelul. Mecanismul de acţiune a rapamicinei şi analogilor săi (zotarolimus, everolimus, biolimus A9 şi novolimus) este reprezentat de inhibarea selectivă a mTOR (mammalian target of rapamycin – ţinta rapamicinei la mamifere), interacţionând cu translaţia şi sinteza unor proteine implicate în ciclul celular, angiogeneză şi glicoliză. Se determină astfel, reducerea nivelurilor factorului de creştere endotelială vasculară şi inhibarea creşterii şi proliferării celulelor endoteliale, tumorale, musculare netede şi fibroblaştilor. [1, 10, 16] Alţi doi analogi ai rapamicinei, utilizaţi în structura DES (tacrolimus şi pimecrolimus) prezintă un mecanism de acţiune diferit, prin legare directă la imunofilina denumită FKBP506, inhibând receptorul calcineurinei şi în consecinţă sinteza de citokine şi determinând inhibarea activităţii celulelor musculare netede. Spre deosebire de blocanţii mTOR, acestea din urmă, nu au dovedit efecte antirestenotice semnificative. [1]
Un alt medicament utilizat în DES este paclitaxel, care îşi manifestă activitatea antirestenotică şi antiinflamatorie prin interferarea cu funcţia microtubulilor. La doze mici, precum cele folosite în DES, paclitaxel are efecte citostatice, fără a determina moarte celulară. Conform studiilor, rezultatele utilizării stenturilor active cu paclitaxel și sirolimus sunt inferioare celor care folosesc ca substanță activă everolimus, în ceea ce privește riscul de revascularizare repetată, infarct miocardic acut și tromboză intra-stent. [16]
Deși utilizarea DES a redus semnificativ riscul de restenoză, acestea sunt asociate cu risc crescut de tromboză intrastent, atât precoce cât și tardivă. Prin urmare, dubla antiagregare plachetară cu aspirină și clopidogrel este indicată cel puțin 12 luni post-implantare. [1]
Implantarea stenturilor active farmacologic este de evitat pacienților care urmează să aibă intervenții chirurgicale extracardiace majore în viitorul apropiat, care nu sunt compatibile cu antiagregarea de durată; implantarea stenturilor metalice la aceștia este o opțiune mai sigură.
Stenturile bioresorbabile
Reprezintă ultima generaţie de stenturi, care practic sunt încorporate de vasul sangvin şi degradate până la compuşi simpli (apă şi dioxid de carbon), refăcând astfel permeabilitatea vasculară şi eliminând riscul de inflamaţie. Avantajul major al stenturilor bioresorbabile este faptul că nu mai necesită tratament antiagregant plachetar a la long, asociat frecvent cu rezistenţă şi complicaţii hemoragice. Alte avantaje includ: posibilitatea efectuării la nevoie a unui RMN (contraindicat în cazul stenturilor metalice), posibilitatea utilizării la copii (la care plasarea unui stent poate interfera cu procesul de creştere), nu reprezintă piedică pentru practicarea unui by-pass coronarian. Stenturile bioresorbabile prezintă flexibilitate crescută, în detrimentul forţei radiale.
Primul stent bioresorbabil a fost implantat în anul 2011, acesta conţinând polimeri de acid lactic (poli-L-lactide, polimer biodegradabil produs din resurse regenerabile precum amidonul de porumb sau trestia de zahăr) şi everolimus (agent antiproliferativ). Un nou stent aprobat în luna mai, anul curent, conţine novolimus ca substanţă activă.
Stentul se resoarbe la câteva luni-ani de la implantare, timpul necesar degradării depinzând de tipul de polimer de acid lactic conținut (D, L izomeri). În general, stenturile formate din polimeri care conțin atât D-lactat, cât și L-lactat prezintă o rată de degradare crescută, rezistență la întindere scăzută și timp de elongație crescut făcând din acestea bune sisteme de livrare a substanței active, comparativ cu stenturile din poli-L-lactat caracterizate printr-o rată de degradare scăzută și o rezistență la întindere crescută, fiind astfel preferate ca și stenturi. [1]
Rezultatele unui studiu care a comparat eficacitatea stentului activ farmacologic conţinând ca substanţă activă sirolimus şi a stentului bioresorbabil, a evidenţiat superioritatea celui de-al doilea, prin reducerea cu 80% a riscului de tromboză intrastent tardivă.
Au fost dezvoltate o serie de stenturi bioresorbabile cu conținut polimeric diferit de poli-L-lactat (stenturi non-poli-L-lactat), care deși pe baza caracteristicilor păreau promițătoare, ulterior, conform unor studii, s-au dovedit a avea rezultate nefavorabile la 4-6 luni de la implantare, cu o rată de crescută a leziunilor post-revascularizare datorate în principal, diametrului redus al stentului.
Avantajele stenturilor bioresorbabile:
- implantarea la nivelul unor zone de stenoză lungi, fără problema existenței unui material metalic permanent, determinând astfel o „reparare” mai fiziologică
- furnizează un suport pentru vindecarea leziunilor arteriale, după care se resoarbe
- evitarea complicațiilor pe termen lung asociate cu implantarea de stenturi permanente (precum remodelarea vasculară tardivă)
- nu interferă cu efectuarea unor explorări RMN
- reduce semnificativ riscul de tromboză tardivă intrastent
- nu exclude posibilitatea unei viitoare intervenții chirurgicale sau intervenționale
- posibilitatea utilizării repetitive la nivelul aceluiași vas
- se pretează foarte bine la copii sau tineri
- nu determină obstrucția ramurilor laterale de către suportul metalic
- sunt potrivite vaselor cu anatomie complexă și a vaselor localizate la nivelul membrelor inferioare [1]
Dezavantajele stenturilor bioresorbabile:
- pierdera precoce a suportului metalic poate duce la restenoză prin remodelare vasculară
- pot determină reacții inflamatorii locale ducând la apariția restenozei
- vizibilitate fluoroscopică scăzută
- sensibilitate crescută la căldură și solvenți, care poate restrânge lista terapiilor farmacologice asociate
- suportul polimeric dens poate împiedica implantarea stenturilor la nivelul vaselor mici
- posibilitatea embolizării unor fragmente de stent în timpul degradării acestuia [1]
Stenturile bioresorbabile polimerice trebuie să fie mai voluminoase și să aibă un schelet mai gros/dens, comparativ cu stenturile metalice simple, pentru a oferi proprietăți mecanice adecvate susținerii peretelui vascular, lucru care este asociat cu anumite dezavantaje. Aceste limitări ale stenturilor bioresorbabile au condus la căutarea alternativelor la materialul din care sunt confecționate, studiindu-se din ce în ce mai mult metalele resorbabile. Un metal resorbabil ideal pentru confecționarea stenturilor ar trebui să prezinte proprietăți mecanice similare stenturilor metalice clasice, să nu altereze funcția endotelială cu un răspuns inflamator sau trombogenic minim și să se degradeze în compuși secundari non-toxici. Magneziul și fierul sunt cele mai promițătoare pentru utilizarea în acest scop, fiind în continuare evaluate. [1, 3]
Magneziul constituie unul dintre cei mai importanți micronutrienți din organismul uman, acționând ca vasodilatator coronarian, produșii de degradare ai magneziului nefiind asociați cu apariția unor reacții adverse importante. Aliajele de magneziu conțin 3 până la 6 mg de magneziu per stent, în funcție de dimensiunea stentului și asocierea cu alte metale. Problema principală a stenturilor bioabsorbabile pe bază de magneziu, este că prezintă un timp de degradare foarte scurt (sub 2 luni) cu pierderea suportului radial înainte de degradarea completă, favorizând astfel remodelarea precoce a peretelui arterial după angioplastie si apariția restenozei. Pentru a combate acest aspect negativ, s-au dezvoltat stenturile bioresorbabile metalice active farmacologic (generând substanțe anti-proliferative care să prevină restenoza), care însă nu s-au dovedit a fi opțiuni viabile pentru tratarea stenozelor coronariene. [1, 13]
Fierul si zincul reprezintă alte metale care sunt luate în vizor pentru dezvoltarea stenturilor bioresorbabile, însă sunt necesare studii clinice care să demonstreze fezabilitatea acestora ca materiale pentru stenturile coronariene. [13]
Cele mai bune rezultate, până în momentul de față, le au stenturile bioabsorbabile din polimeri de acid lactic și everolimus.
Angioplastia coronariană cu stent
Angioplastia coronariană transluminală percutanată a fost introdusă în anul 1977 de către Andreas Gruentzig, considerat părintele cardiologiei intervenţionale. Angioplastia cu balon prezintă dezavantajul de a realiza o deschidere inegală a lumenului coronarian, care putea fi urmată de reculul plăcilor ateromatoase localizate endarterial, cu îngustarea şi mai accentuată a acestuia, asociată cu disecţie focală a peretelui arterial datorată dilatării balonului. [1]
Conform studiilor, angioplastia cu stent este asociată cu rezultate imediate şi tardive superioare angioplastiei simple cu balon.
Procedura angioplastiei cu stent se realizează sub control radioscopic și poate consta fie din stentare directă, fie din predilatare cu balon urmată de implantarea stentului. Pentru abordul arterial se puncționează artera femurală sau artera radială, prin care se introduce și avansează ghidul flexibil până la nivelul arterei coronariene stenozate, urmat de introducerea cateterului. Predilatarea cu balon este utilizată în multe cazuri pentru a facilita poziționarea stentului. Leziunile aterosclerotice fibrotice, calcificate pot împiedica expansionarea completă a stentului (în cazul stentării directe), lăsând în urmă un stent deschis pe jumătate, cauză de tromboză subacută intra-stent. [2] Cateterul cu balonul inflabil atașat la capăt este introdus pe ghid și avansat până la nivelul plăcii ateroclerotice stenozante, unde este umflat utilizând diferite presiuni și comprimând astfel placa de peretele vascular. Balonul este apoi dezumflat iar cateterul retras. Urmează introducerea cateterului cu stentul atașat, care odată plasat la nivelul zonei stenozate este destins, atașându-se peretelui intern arterial. Cele două etape pot fi practicate și invers cu implantarea, într-o primă fază, a stentului peste placa aterosclerotică, urmată de dilatare cu balon, pentru expansiunea optimă a stentului, fie se poate practică stentare directă fără utilizarea balonului.
Embolizarea distală prin desprinderea de material aterosclerotic în timpul procedurilor intervenționale, necesită utilizarea dispozitivelor de protecție distală (filtre sau baloane ocluzive) sau a dispozitivelor de protecție proximală, pentru prevenirea complicațiilor aferente embolizării.
Indicaţiile angioplastiei coronariene cu stent
Angioplastia coronariană cu stent este eficientă pentru ameliorarea simptomelor la pacienții cu boală coronariană uni- sau multivasculară, chiar și atunci când este aplicată unor stenoze cu risc înalt. [11] Stentarea coronariană este indicată la pacienţii cu angină pectorală stabilă, la cei cu angină instabilă, cu leziuni coronariene critice, cu dureri persistente în ciuda tratamentului farmacologic maximal, celor cu by-pass care au dezvoltat leziuni aterosclerotice pe grafturile venoase, în ocluzii totale cronice şi la pacienţii cu infarct miocardic în fază acută (revascularizarea la aceştia trebuie practicată într-un anumit interval de timp, optim în primele 6 ore de la debutul simptomelor, până la maxim 12 ore). Angioplastia cu stent s-a dovedit superioară tratamentului trombolitic în ceea ce priveşte mortalitatea, rata de reinfarctizare şi evenimente cardiovasculare, atât în IMA cu supradenivelare de segment ST, cât şi în infarctul fără supradenivelare ST.
Stentarea coronariană se recomandă și în cazurile în care angioplastia cu balon se soldează cu risc crescut de ocluzie vasculară prin disecţie sau recul al plăcii de ateroscleroză post-dilatare cu balon („stentare de salvare”) sau în cazul în care există rezultate suboptimale după angioplastia cu balon. Beneficiul major al implantării de stent coronarian este reprezentat de capacitatea de a permeabiliza chiar şi vasele obliterate în mod neaşteptat, evitând necesitatea practicării unei intervenţii chirurgicale de reperfuzie miocardică. [1]
Studiile clinice au evidenţiat superioritatea utilizării stenturilor coronariene în orice subtip de leziune coronariană, acestea scăzând incidenţa evenimentelor cardiovasculare fatale sau non-fatale, comparativ cu angioplastia simplă cu balon. Singurele situaţii în care angioplastia cu stent este contraindicată sau este inferioară celei cu balon sunt leziunile prea mici pentru a permite plasarea unui stent (în general sub 2,25 mm) sau la pacienţii cu contraindicaţie de antiagregare plachetară (absolut necesară post-angioplastie cu stent). [1]
Există o serie de indicații pentru implantarea stenturilor active farmacologic, în prezent de clasa IIA nivel de evidență C: vase mici, ocluzii totale cronice, diabet insulino-dependent, leziuni pe grefe de by-pass, boală multivasculară, trunchi principal neprotejat, restenoză intra-stent. [9, 16] Există autori care consideră stentarea trunchiului principal coronarian neprotejat doar în absența altei modalități de revascularizare (de exemplu, când chirurgia cu by-pass prezintă risc perioperator crescut). Ghidurile European și American contraindică, de asemenea, intervenția percutanată cu stent de orice fel la pacienții cu leziune importantă de trunchi comun eligibili pentru tratament chirurgical. Conform ghidurilor, intervenția percutanată de trunchi comun este admisă în anumite situații limitate, precum infarct miocardic acut cu ocluzie la nivelul trunchiului, leziune indusă la angioplastie în alt teritoriu care necesită intervenție de urgență la nivelul trunchiului comun, stenoză de trunchi protejat post-bypass cu disfuncție parțială de grefon, leziune de trunchi comun neprotejat la pacienții cu risc înalt sau contraindicație pentru by-pass coronarian. Studiul SYNTAX a evidențiat în acest sens, rezultate excelente în intervenția cu stent la nivelul trunchiului comun (mai ales în leziune ostială și mijlocie), concluzionându-se că leziunea ostială și de corp a trunchiului coronarian comun poate fi tratată prin angioplastie ca metodă de elecție. [17]
Complicații asociate implantării de stenturi coronariene
Restenoza coronariană
Restenoza coronariană reprezintă răspunsul peretelui arterial la o iritație mecanică, fiind la ora actuală cel mai redutabil obstacol din cardiologia intervenţională, putînd afecta atât vasele native, cât şi grefele şi stenturile. Mecanismul restenozei este complex, fiind diferit în rândul angioplastiei cu balon, BMS și DES: restenoza asociată stenturilor metalice simple apare prin proliferare neointimală prin migrarea celulelor musculare netede un proces reparativ fiziologic, dar exagerat în cazul BMS; mecanismul restenozei la stenturile active farmacologic este variabil incluzând proliferare celulară (limfocite T) și depozite de fibrină, datorită unei reacții cronice inflamatorii asociată DES. [1] În cazul stenturilor metalice restenoza apare ca un mecanism difuz, în timp ce în cazul DES aceasta este focală (sub 10 mm) cu alternarea zonelor de restenoză avansată cu cele în care restenoza lipsește cu desăvârșire. În majoritatea cazurilor, restenoza focală a stenturilor active farmacologic se poziționează marginal, în multe cazuri interesând ambele margini (fenomen de „candy restenosis” care conferă un aspect angiografic de „bomboană” segmentului afectat). [14]
Cea mai comună manifestare clinică a restenozei coronariene este reapariția durerilor anginoase. Infarctul miocardiac acut ca primă manifestare a restenozei este foarte rar, speculându-se faptul că leziunea restenotică fibroproliferativă este mai puțin predispusă la ruptura plăcii decât este placa aterosclerotică nativă. [11]
Fenomenul de restenoză apare, în mod obişnuit, la 3-6 luni după procedura coronariană şi poate fi de două tipuri: restenoză clinică şi restenoză angiografică.
Restenoza clinică se defineşte prin apariţia durerilor anginoase sau pozitivarea testelor care obiectivează ischemia. Angina pectorală apare cel mai frecvent la efort, rareori instalându-se un sindrom coronarian acut. [5, 12]
Restenoza angiografică constă în apariţia unei stenoze > 50% în zona dilatată cu stent la un anumit interval de timp (poate sau nu să asocieze fenomene clinice). Studii experimentale fiziologice demonstreză că reducerea lumenului arterial cu peste 50% face ca rezerva sangvină coronariană să devină insuficientă. [1] Prezența restenozei angiografice are valoare predictivă limitată în ceea ce privește apariția evenimentelor clinice, până la 30% dintre pacienții cu restenoză angiografică fiind asimptomatici. [12] Aparenta discordanță dintre restenoza angiografică și rezultatul clinic este probabil legată de starea vaselor colaterale, de revascularizarea incompletă sau de progresia procesului ateroclerotic în alte artere, precum și de limitările unei definiții dihotomice a restenozei, leziunile stenozante intermediare care interesează 50-75% din diametrul arterial deși sunt definite ca restenoză și clasificate cu împreună cu leziuni mai severe, este foarte puțin probabil ca acestea să fie simptomatice. [11]
Deși angiografia coronariană este procedura de elecție pentru identificarea restenozei, există alte tehnici imagistice moderne precum ultrasonografia intravasculară și tomografia în coerență optică, care au îmbunătățit abilitatea de vizualizare a restenozei și estimarea cantitativă a grosimii neointimale, volumului neointimal și a diametrului minim al lumenului.
În general, restenoza post-angioplastie cu balon se tratează prin implantare de stent, în timp ce restenoza intra-stent se tratează prin „cutting balloon” urmat de expandare corespunzătoare cu balon. [5] Brahiterapia intracoronariană reprezintă singurul tratament non-invaziv, recomandat, bazat pe dovezi, pentru restenoza intra-stent. Post-iradiere este necesară dubla antiagregare plachetară cu clopidogrel și aspirină 6 luni-1 an, pentru prevenirea trombozei tardive de stent.
Tromboza intrastent
Reprezintă formarea unui tromb (cheag de sânge) la nivelul arterei stentate. În funcție de intervalul de timp de la montarea stentului, există mai multe tipuri de tromboză de stent:
(1) intra-procedurală, este rară și se poate datora medicației intraprocedurale insuficiente, unui status procoagulant, placă aterosclerotică instabilă sau unui sindrom coronarian acut.
(2) acută, apare în primele 24 de ore
(3) subacută, apare între 24 de ore și 28-30 de zile
(4) tardivă, în primul an post-stentare, determinată de lipsa reendotelizării stentului, fiind asociată de obicei cu implantarea DES, poate apărea, de asemenea, în cazul opririi precoce a tratamentului antiagregant plachetar (sub 1 an)
(5) foarte tardivă, apărută la un interval de peste 1 an de la implantare [9, 15]
Întârzierea reendotelizării în cazul stenturilor active farmacologic este benefică pentru prevenirea restenozei, însă datorită efectului antiproliferativ, lasă scheletul metalic descoperit favorizând apariția trombozei.
Factorii favorizanți pentru tromboza intra-stent sunt:
- probleme legate de stent (expansionare insuficientă, trombogenicitate, malapoziție)
- plasarea unui stent mic și lung într-un vas cu diametru redus și flux lent
- stenoze lungi sau la bifurcație
- disecție reziduală
- întreruperea precoce a tratamentului antiagregant
- rezistență la tratamentul antiagregant plachetar (lipsa citocromului responsabil de metabolizarea clopidogrelului, asocierea cu medicamente care interferă cu tratamentul antiagregant (exemplu: inhibitorii de pompă de protoni)
- diabet zaharat
- sindrom coronarian acut
- vârstă înaintată
- status procoagulant
- disfuncție ventriculară stângă cu fracție de ejecție scăzută [15]
Alte complicații asociate angioplastiei cu stent sunt:
- hemoragie la locul de puncție
- aritmii
- leziuni vasculare determinate de introducerea cateterului
- afectare renală sau diferite alergii datorită utilizării substanței de contrast
- infecții [4]
Recomandări pentru pacienţii purtători de stenturi coronariene
- în prima săptămână după implantarea stentului este indicată evitarea efortului fizic sau ridicarea greutăţilor mai mari de 5-10 kg
- tratamentul antiagregant trebuie respectat cu stricteţe, în funcţie de indicaţiile medicului (în general, se indică dublă antiagregare plachetară timp de minim 1 an în cazul DES și minim 1 lună în cazul BMS); [4] antiagregantele nu trebuie întrerupte pentru proceduri minore, precum intervențiile stomatologice
- timp de cel puţin 6 luni după implantarea stentului este contraindicată efectuarea unui RMN
- în condiţiile apariţiei durerilor anginoase este necesară prezentarea de urgenţă la medic
- este absolut necesar tratamentul comorbidităţilor precum şi minimalizarea factorilor de risc pentru boala coronariană aterosclerotică (abandonul fumatului, moderarea consumului de alcool, combaterea sedentarismului, optimizarea greutăţii corporale şi adoptarea unei diete săracă în grăsimi şi sare)
- este necesar un control cardiologic periodic
2. Nguyen T.N., Colombo A., Hu D., Grines C.L., Saito S. Practical Handbook of Advanced Interventional Cardiology: Tips and Tricks. 3rd ed., Blackwell Publishing, 2008; 6:97-101
3. Coronary Artery Stents. The New England Journal of Medicine; link: https://www.nejm.org/doi/full/10.1056/NEJMra051091
4. Stents. National Institutes of Health; link: https://www.nhlbi.nih.gov/health/health-topics/topics/stents/
5. Restenoza; link: https://www.mdd.ro/informatii-pacienti/restenoza
6. Coronary artery stents: identification and evaluation; link: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1770873/
7. Stentul; link: https://www.mdd.ro/informatii-pacienti/stentul
8. A comparison of balloon-expandable-stent implantation with balloon angioplasty in patients with coronary artery disease. Benestent Study Group; link:
https://www.ncbi.nlm.nih.gov/pubmed/8041413
9. Stenturi active farmacologic, pg 27-30; link: https://www.static.mediamed.ro/mediaLibrary/ghiduri/ghid2007.pdf
10. Sirolimus; link: https://en.wikipedia.org/wiki/Sirolimus
11. Braunwald E. Heart Disease Tratat de Boli Cardiovasculare. vol.1, Ed. M.A.S.T., 2000; 39:1372,1378-1379
12. Topol E.J. Textbook of Cardiovascular Medicine. 3rd ed., Lippincott Williams & Wilkins, Philadelphia, 2007; 83:1847-1853
13. Bioresorbable Stents; link: https://en.wikipedia.org/wiki/Bioresorbable_stents
14. Mecanismele de restenoză intrastent analizate prin ultrasonografia intracoronariană, Curierul Medical; link: https://usmf.md/wp-content/uploads/2013/curier/CM_5-2011.pdf
15. Stent thrombosis: definitions, mechanisms and prevention; link: https://www.escardio.org/communities/councils/ccp/e-journal/volume5/Pages/vol5n32.aspx#.UhKM6D_4s2A
16. Drug-Eluting Coronary Artery Stents. The New England Journal of Medicine; link:
https://www.nejm.org/doi/full/10.1056/NEJMra1210816
17. Impactul stenturilor active farmacologic asupra strategiei de revascularizare în boala coronariană. Progrese în cardiologie vol.4, pg.135-143; link: https://www.static.mediamed.ro/mediaLibrary/progrese/progrese4.pdf
Copyright ROmedic: Articolul se află sub protecția drepturilor de autor. Reproducerea, chiar și parțială, este interzisă!